Ini adalah dasar penentuan bilangan oksidasi, yang dipelajari dalam SMA kelas X semester 2
 Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron suatu atom
yang dilepaskan atau diterima atom dalam senyawa, dimana senyawa tersebut
terbentuk melalui ikatan ionik. Tanda (+) dan (-) pada biloks ditulis
sebelum angkanya misalnya +2, sedangkan pada muatan ditulis sesudah angkanya,
misalnya 2+.
Bilangan oksidasi adalah angka yang menunjukkan jumlah elektron suatu atom
yang dilepaskan atau diterima atom dalam senyawa, dimana senyawa tersebut
terbentuk melalui ikatan ionik. Tanda (+) dan (-) pada biloks ditulis
sebelum angkanya misalnya +2, sedangkan pada muatan ditulis sesudah angkanya,
misalnya 2+.
Cara menentukan bilangan oksidasi suatu unsur
dalam ion atau senyawanya mengikuti aturan-aturan sebagai berikut :
a. Bilangan oksidasi unsur bebas ( atom atau molekul unsur) adalah 0 (nol).
Contoh: Ne, H2, O2,Cl2,P4,C,Cu,Fe
dan Na.
b. Bilangan oksidasi ion monoatom dan poliatom sama dengan muatan ionnya.
Contoh : untuk ion monoatom Na+, Ca2+, dan Cl-
memiliki bilangan oksidasi berturut-turut +1,+2 dan -1.
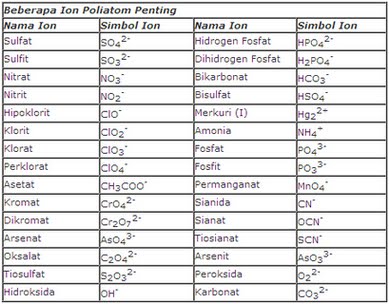
Contoh : untuk ion poliatom NH4+, SO42-,
dan PO43- memiliki bilangan oksidasi berturut-turut
+1, -2, dan -3.
c. Bilangan oksidasi unsur golongan IA adalah +1 dan unsur golongan IIA adalah +2. Misalnya, bilangan oksidasi unsur
Na pada senyawa NaCl, Na2SO4, dan Na2O adalah
+1. Bilangan oksidasi unsur Ca pada senyawa CaCl2, CaSO4,
dan CaO adalah +2.
d. Bilangan oksidasi unsur golongan VIA pada senyawa biner adalah -2
dan unsur golongan VIIA pada senyawa biner adalah -1. Misalnya,
bilangan oksidasi unsur S pada Na2S dan MgS adalah -2. Bilangan
oksidasi unsur Cl pada NaCl, KCl, MgCl2, dan FeCl3 adalah
-1.
e. Bilangan oksidasi unsur H pada senyawanya adalah +1. Misalnya,
bilangan oksidasi unsur H pada H2O, HCl, H2S, dan NH3
adalah +1. Bilangan oksidasi unsur H pada senyawa hidrida adalah -1.
Misalnya, bilangan oksidasi unsur H pada NaH, CaH2, dan AlH3
adalah -1.
f. Bilangan oksidasi unsur O pada senyawanya adalah -2, kecuali pada
senyawa biner dengan F, bilangan oksidasi unsur O-nya adalah +2. Bilangan
oksidasi unsur O pada senyawa peroksida, seperti H2O2
dan BaO2 adalah -1. Dalam senyawa superoksida bilangan
oksidasinya adalah -1/2, seperti pada KO2 dan NaO2.
g. Jumlah
bilangan oksidasi untuk semua atom unsur dalam molekul atau senyawa adalah 0.
Jumlah bilangan oksidasi untuk atom atau unsur pembentuk ion poliatom sama
dengan muatan ion poliatomnya. Misalnya, ion NH4+ mempunyai
jumlah bilangan oksidasi unsur N adalah -3 dan H adalah +1.
Molekul NaCl terdiri dari atom Na
dan atom Cl. Jumlah biloks senyawanya adalah 0, sedangkan biloks Na adalah +1
sehingga biloks Cl dapat dicari dengan rumus :
biloks Na + biloks Cl
= 0
+1
+ biloks Cl = 0
Biloks
Cl = -1
Molekul V2O3
terdiri dari 2 atom V dan 3 atom O. Jumlah biloks molekul tersebut adalah 0,
biloks O adalah -2 sehingga biloks V dapat dicari dengan rumus :
2(biloks V) + 3(biloks O)
= 0
2(biloks V) + 3(-2) = 0
2(biloks V)
= +6
Biloks V
= +3
Molekul NH4+ terdiri
dari atom N dan 4 atom H. Jumlah biloks unsur pembentuk ion poliatom tersebut
adalah +1, biloks H adalah +1 sehingga biloks N dapat dicari dengan rumus :
(biloks N) + 4(biloks
H) = 0
(biloks N) +
4(+1) = +1
Biloks N
= -3
kami tunggu kreksi dari teman- teman sekalain , makasih semoga bermanfaat
kami tunggu kreksi dari teman- teman sekalain , makasih semoga bermanfaat







